COMPARACIÓN DE LA COMBINACIÓN DE VACUNAS HETERÓLOGAS vs. USO CONVENCIONAL DE VACUNAS HOMÓLOGAS CONTRA EL COVID-19
Ronald Palacios Castrillo, M.D.,PhD.
A pesar del desarrollo de múltiples vacunas exitosas contra el coronavirus SARS-CoV-2, la continua aparición de variantes y la distribución mundial esporádica de vacunas han limitado y seguirán limitando la efectividad de la vacuna. Otro problema en el esfuerzo mundial de las vacunas ha sido la aparición de eventos raros como la trombosis y el síndrome de trombocitopenia asociados con las vacunas basadas en adenovirus. Esto provocó el cese de la distribución de la vacuna ChAdOx1 nCoV-19 (ChAd) de AstraZeneca en muchos países, así como un aumento en la población con temor a vacunarse.
Los estudios recientes de Barros-Martins et al.( Nat. Med. https://doi.org/10.1038/s41591-021-01449-9 ,2021 ) y Schmidt et al. ( Nat. Med. https://doi.org/10.1038/s41591-021-01464-w , 2021 ) capitalizan la vacunación incompleta que resultó de la suspensión de la vacunación con ChAd en varios países europeos, que dejaron parcialmente vacunados y se les ofreció la opción de completar sus vacunas con una vacuna de ARNm (BNT162b2 (BNT), de Pfizer – BioNTech); o ARNm-1273, de Moderna).
Barros-Martins, et.al., informan que, en comparación con los resultados obtenidos con la dosificación homóloga de ChAd-ChAd, la estrategia de dosificación de ChAd-BNT dió como resultado respuestas inmunes de inmunoglobulina G (IgG) e IgA significativamente mayores dirigidas contra la proteína S( pico) del SARS-CoV-2 y robustas, de 20 a> Títulos 60 veces mayores de anticuerpos neutralizantes contra las variantes del SARS-CoV-2 Alfa (B.1.1.7), Beta (B.1.351) y Gamma (P.1) 2.
=> Recibir por Whatsapp las noticias destacadas
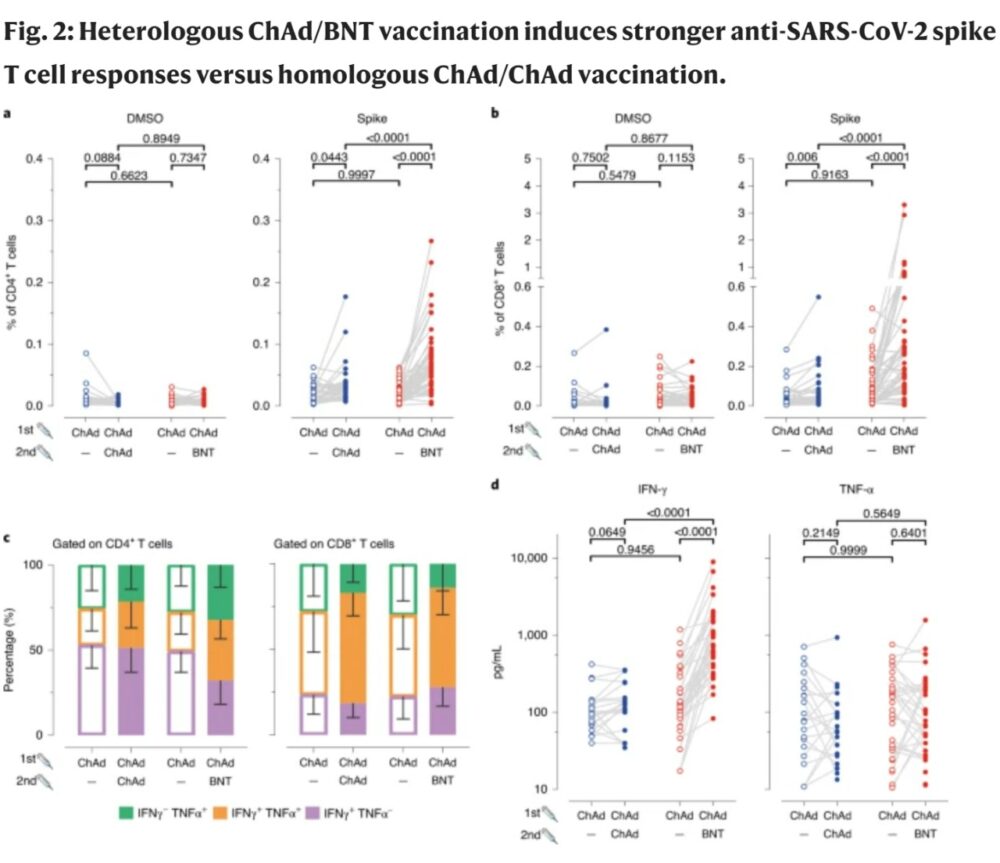
Estos títulos neutralizantes fueron aproximadamente tres veces más altos que los del suero de los grupos tratados con BNT-BNT (aunque con diferentes intervalos entre la dosis 1 y la dosis 2), con títulos más altos de las subclases IgG e IgA. Del mismo modo, Schmidt et al. encontraron títulos significativamente más altos de anticuerpos IgG dirigidos contra la proteína S del SARS-CoV-2 y el dominio de unión al receptor ACE2 ,después de la vacunación con ChAd-mRNA ( ya sea BNT162b2 o mRNA-1273) que después de la vacunación homóloga ChAd-ChAd3. Además, los participantes a los que se les administró las vacunas ChAd-mRNA demostraron un mayor número de células T CD4 + y CD8 + específicas contra proteína S , así como células T productoras de citocinas, que los participantes que recibieron ChAd-ChAd.
Schmidt y col. encontraron respuestas comparables de células T CD4 + multifuncionales específicas contra la proteína S , pero mayores respuestas de células T CD8 + en el grupo de vacunados con esquema ChAd – ARNm. Un tercer estudio, publicado recientemente en Lancet, proporciona evidencia adicional de que la combinaciòn de vacuna heteróloga ChAd-ARNm es bien tolerada y estimula una sólida respuesta de IgG y anticuerpos neutralizantes ( Borobia, A. M. et al. Lancet 398, 121–130 ,2021 ). Tomados en su conjunto, estos estudios muestran mejores resultados de inmunogenicidad con dosis heterólogas y sugieren una posible superioridad de esta estrategia sobre los regímenes homólogos de primera dosis-refuerzo para las respuestas celulares y la neutralización de variantes .
Como indican estos nuevos estudios, la validación de la inmunogenicidad y de la estrategia de «mezclar y combinar» con diferentes vacunas aprobadas , puede ofrecer una solución que podría ayudar a mitigar la escasez e interrupciones del suministro de vacunas. Los resultados que documentan mejores respuestas de inmunización , sugieren también que una estrategia de uso de vacuna heteróloga puede superar las limitaciones de las plataformas de vacuna individuales. La efectividad en la inmunización y el grado de respuesta inmune en respuesta a las vacunas vectorizadas por adenovirus está limitada por los anticuerpos neutralizantes preexistentes contra los serotipos de adenovirus comunes a los que están expuestos los seres humanos, y puede comprometer la capacidad de generar una respuesta inmune a la proteína S del SARS-CoV-2, como reportaron en la formulación de vectores de adenovirus de tipo 5 de CanSino Biologics – Instituto de Biotecnología de Beijing. El uso de un vector adenoviral no humano, como la vacuna ChAd de Astra Zeneca , o el uso de serotipos de adenovirus recombinantes heterólogos (rAd26 seguido de rAd5), como se observa en la vacuna rusa Gamaleya Sputnik V, permite que las plataformas de vacunas basadas en adenovirus administren la proteína S(pico) del SARS-CoV -2 de una manera que teóricamente generaría una respuesta inmune mejorada. Sin embargo, las plataformas de vacunas basadas en adenovirus están limitadas porque inducen fuertes respuestas de células T pero son menos efectivas para desarrollar respuestas de anticuerpos neutralizantes.
Los extensos estudios preclínicos y clínicos de fase temprana, en particular en el desarrollo de vacunas contra el virus de la inmunodeficiencia humana, han demostrado desde hace mucho tiempo las posibles ventajas inmunológicas de las estrategias de vacunación heterólogas de primer-refuerzo. Los anticuerpos neutralizantes específicos contra la proteína S (pico) son capaces de prevenir la infección por SARS-CoV-2 en modelos animales, y estos anticuerpos han servido como marcador para una respuesta protectora a la vacuna, aunque no se han confirmado umbrales precisos en humanos.
Aunque la seroconversión ( producciòn de anticuerpos neutralizantes) se evalúa más fácilmente , las respuestas de las células T contribuyen grandemente a la eliminación viral después de la infección; estas células T pueden generar una respuesta más robusta a variantes emergentes recientemente, y pueden generarse incluso en ausencia de respuestas de anticuerpos detectables en receptores de trasplantes inmunodeprimidos. La incorporación de vacunas que provocan principalmente respuestas humorales (p. Ej., Vacunas basadas en proteínas) y aquellas que provocan fuertes respuestas celulares (p. Ej., Vacunas basadas en vectores virales) en plataformas heterólogas de primera dosis-refuerzo puede, por lo tanto, mejorar la amplitud de la inmunidad al SARS-CoV-2 .
Los estudios en animales sugieren que la vacunación heteróloga contra el SARS-CoV-2 mejora las respuestas de los linfocitos T de ayuda tipo 1(TH1) específicos contra la proteína S , así como los niveles de anticuerpos IgA específicos contra la proteína S. Cada vez hay más pruebas que demuestran que el uso de una primera dosis con vacuna vectorizada por adenovirus seguido de un refuerzo de ARNm en un intervalo de 6 a 12 semanas es seguro y proporciona una mayor respuesta inmunitaria humoral y celular, que la estrategia de usar vacuna homóloga de ChAd-ChAd. Actualmente, se están realizando estudios en el Reino Unido, y más recientemente en los EE. UU., para investigar la estrategia de «mezclar y combinar» de manera prospectiva. Estas estrategias de vacunas heterólogas pueden proporcionar una mayor efectividad a las vacunas contra el SARS-CoV-2 en el contexto de variantes que surgen continuamente.
La probabilidad de que se requieran vacunas de refuerzo, ya sea para estimular la disminución de la inmunidad o para incrementar la amplitud de la inmunidad a las variantes del SARS-CoV-2, refuerza aún más la importancia de optimizar la inmunogenicidad de las vacunas. Hasta ahora, las vacunas de ARNm han demostrado una eficacia continua contra la variante B.1.1.7, con una eficacia reducida pero continua contra las variantes circulantes B.1.351 y P.112. Esto sugiere que la sólida respuesta de anticuerpos neutralizantes inducida por la plataforma de ARNm puede proporcionar la amplitud de la respuesta inmune humoral necesaria para superar las mutaciones genéticas dentro de las variantes del SARS-CoV-2. Esto contrasta con el rendimiento de la vacuna AstraZeneca, que, a pesar de generar una respuesta robusta de células T, ha demostrado tener un desempeño pobre frente a la variante B.1.35113. Como es habitual, no existen datos o estudios publicados con relación a la vacuna Sputnik V .
Dada la amenaza constante de las variantes circulantes actuales y futuras, están en curso estudios que exploran estrategias alternativas de refuerzo de secuencia (p. Ej., Vector viral después de la plataforma de ácido nucleico), dosis de vacuna adicionales después de una serie completa de vacunas contra el SARS-CoV-2 o variando el número de las dosis de refuerzo después de la vacunación primaria . Además, el intervalo entre la primera dosis y el refuerzo probablemente tenga un papel fundamental.
Estas estrategias pueden ser de particular importancia para mejorar las respuestas inmunitarias en pacientes inmunodeprimidos, incluidos aquellos con neoplasias malignas o trasplantes ó por uso de medicamentos inmunosupresores. Los receptores de trasplantes de órganos sólidos y los pacientes con neoplasias hematológicas han mostrado respuestas humorales más bajas a las vacunas aprobadas contra COVID-19 (Thakkar, A. et al. Cancer Cell https://doi.org/10.1016/j.ccell.2021.06.002 ,2021). La combinación de dos estrategias de vacuna que ofrecen estimulación complementaria de diferentes vías inmunitarias puede inducir de manera más eficaz respuesta de células B de larga duración y respuestas de células T potentes.
Aunque desencadenadas por la desafortunada interrupción en el uso de vacunas basadas en adenovirus, las estrategias de dosificación mixta multiplataforma han demostrado resultados de inmunogenicidad ventajosos, medidos tanto por las respuestas humorales como por las respuestas celulares al SARS-CoV-2 original y sus variantes. Estos programas innovadores de dosificación de vacunas pueden ser necesarios tanto como prueba contra las interrupciones del suministro de vacunas como para maximizar las respuestas inmunitarias, lo que a su vez ayudará a reducir la transmisión de variantes emergentes y protegerá a las personas inmunodeprimidas.